
Pfizer/Biontech hanno annunciato l'avvio di una domanda di licenza per prodotti biologici con la Food and Drug Administration statunitense per l'approvazione del loro vaccino mRNA Covid-19; anche Moderna ha presentato la medesima richiesta martedì alla FDA.
Pfizer/Biontech hanno richiesto una "licenza biologica" per il loro vaccino COVID-19 per individui di età pari o superiore a 16 anni, un cambio rispetto alla sua attuale autorizzazione emergenziale; ciò aprirebbe la strada al commercio interstatale e consentirebbe al produttore di farmaci di commercializzare i vaccini direttamente ai consumatori.
Inoltre Pfizer/Biontech stanno cercando di accelerare la piena approvazione nell'ambito di una revisione prioritaria presentando i dati non clinici e clinici necessari per supportare l'autorizzazione del vaccino COVID-19.
L'approvazione di una licenza biologica consentirà di mantenere il vaccino sul mercato una volta terminata l'emergenza sanitaria e consentirà all'azienda di pubblicizzare il prodotto al pubblico, cosa non consentita in caso di uso emergenziale.
Il fatto più preoccupante è che Pfizer/Biontech hanno anche presentato una domanda per espandere l'attuale autorizzazione all'uso emergenziale per il loro vaccino COVID-19 per includere individui di età compresa tra 12 e 15 anni.
Le aziende intendono presentare un BLA (licenza biologica) supplementare per supportare l'autorizzazione del vaccino in questa fascia di età una volta disponibili i dati richiesti sei mesi dopo la seconda dose di vaccino.
Il vaccino Pfizer-BioNTech COVID-19, che si basa sulla tecnologia mRNA proprietà di BioNTech, è stato sviluppato sia da BioNTech che da Pfizer. Essi sono i titolari dell'autorizzazione all'immissione in commercio in Europa e i titolari delle autorizzazioni all'uso in emergenza o equivalenti negli Stati Uniti nel Regno Unito, in Canada e in altri paesi.
Martedì Moderna ha richiesto alla FDA la licenza biologica per il suo vaccino COVID-19 come già precedentemente richiesto da Pfizer-BioNTech.
Sempre ieri il National Institutes of Health (NIH), ha annunciato di aver avviato una sperimentazione clinica su adulti completamente vaccinati contro COVID-19 che ricevono dosi di richiamo del vaccino per informare le decisioni di politica pubblica in merito alla sicurezza, alla programmazione e all'efficacia delle vaccinazioni.
Il NIH ha affermato che i risultati iniziali della sperimentazione sono previsti per la fine dell'estate di quest'anno.
Ringraziamo per la diffusione dei nostri contenuti , chiediamo solo di citare OMV come fonte.
VIDEO NEWS

SCIENZE
MEDICINA

INTERVISTE

INTERVISTE

INTERVISTE

POLITICA
MEDICINA
MEDICINA
-
 08/07/2023
08/07/2023 -
 18/05/2023
18/05/2023 -
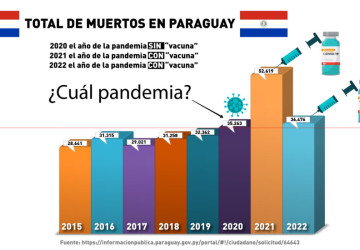 20/03/2023
20/03/2023 -
 11/03/2023
11/03/2023 -
 08/03/2023
08/03/2023 -
 23/02/2023
23/02/2023 -
 16/02/2023
16/02/2023 -
 15/02/2023
15/02/2023 -
 14/02/2023
14/02/2023 -
 04/02/2023
04/02/2023 -
 29/01/2023
29/01/2023 -
 26/01/2023
26/01/2023 -
 26/01/2023
26/01/2023 -
 21/01/2023
21/01/2023
-
 20/05/2021
20/05/2021 -
 21/09/2021
21/09/2021 -
 15/03/2021
15/03/2021 -
 21/07/2021
21/07/2021 -
 06/09/2021
06/09/2021 -
 30/10/2021
30/10/2021 -
 03/08/2021
03/08/2021 -
 27/10/2021
27/10/2021 -
 02/05/2021
02/05/2021 -
 05/05/2021
05/05/2021 -
 08/03/2021
08/03/2021 -
 02/08/2021
02/08/2021 -
 05/10/2021
05/10/2021 -
 10/06/2021
10/06/2021

 Traduttore
Traduttore

LEAVE A COMMENT
Facebook Conversations