
Il 2 novembre 2021, sul British Medical Journal, è stata pubblicata un'inchiesta che denuncia problemi relativi alla sicurezza durante la fase di sperimentazione del vaccino Comirnaty, alla falsificazione di dati ed a ritardi sul monitoraggio degli effetti collaterali.
Da poche ore si sente parlare di Pfizergate, lo scandalo che sta colpendo la Pfizer. Di cosa si tratta?
Il 2 novembre 2021 è stata pubblicata un' inchiesta sulla rivista medica britannica British Medical Journal che riporta problemi relativi alla falsificazione dei dati e di sicurezza su uno dei siti scelti dal laboratorio Pfizer per condurre i suoi studi clinici sul vaccino Comirnaty contro il Covid-19.
Dall' inchiesta si evince che " Le rivelazioni di pratiche inadeguate presso una società di ricerca a contratto che aiuta a svolgere l'importante sperimentazione del vaccino contro il covid-19 di Pfizer sollevano interrogativi sull'integrità dei dati e sulla supervisione normativa. Un direttore regionale che è stato impiegato presso l'organizzazione di ricerca Ventavia Research Group ha detto al BMJ che la società ha falsificato i dati, ha scoperto i pazienti, ha impiegato vaccinatori non adeguatamente formati ed è stata lenta nel seguire gli eventi avversi riportati nello studio cardine di fase III di Pfizer. Il personale che ha condotto i controlli di qualità è stato sopraffatto dal volume di problemi riscontrati. Dopo aver ripetutamente informato Ventavia di questi problemi, il direttore regionale, Brook Jackson, ha inviato un reclamo tramite e-mail alla Food and Drug Administration (FDA) statunitense. Ventavia l'ha licenziata lo stesso giorno. Jackson ha fornito il BMJ con decine di documenti aziendali interni, foto, registrazioni audio ed e-mail".
La sperimentazione clinica della fase 3 del vaccino Comirnaty di Pfizer è iniziata il 27 luglio 2020. Pfizer era responsabile della progettazione e della conduzione dello studio, della raccolta dei dati, dell'analisi dei dati, dell'interpretazione dei dati e della stesura del manoscritto finale. Ventavia Research Group è uno dei 152 siti in tutto il mondo che si sono dedicati alla sperimentazione.
Il rapporto prosegue evidenziando che" Jackson ha detto al BMJ che, durante le due settimane in cui è stata impiegata presso Ventavia nel settembre 2020, ha ripetutamente informato i suoi superiori della cattiva gestione del laboratorio, dei problemi di sicurezza dei pazienti e dei problemi di integrità dei dati. Jackson era un revisore esperto in studi clinici che in precedenza aveva ricoperto la posizione di direttore delle operazioni ed è arrivato in Ventavia con oltre 15 anni di esperienza nel coordinamento e nella gestione della ricerca clinica. Esasperato dal fatto che Ventavia non avesse a che fare con i problemi, Jackson ha documentato diverse questioni una sera tardi, scattando foto sul suo cellulare. Una foto, fornita a The BMJ, mostrava gli aghi gettati in un sacchetto di plastica a rischio biologico invece che in una scatola di contenitori per oggetti taglienti. Un altro ha mostrato materiali di confezionamento del vaccino con i numeri di identificazione dei partecipanti alla sperimentazione scritti su di essi lasciati all'aperto, potenzialmente i partecipanti non accecati. I dirigenti di Ventavia hanno poi interrogato Jackson per aver scattato le foto".
La pubblicazione fa riferimento anche ad un'ispezione della FDA "Nella sua e-mail del 25 settembre alla FDA, Jackson ha scritto che Ventavia aveva arruolato più di 1000 partecipanti in tre siti. Lo studio completo (registrato con NCT04368728 ) ha arruolato circa 44000 partecipanti in 153 siti che includevano numerose società commerciali e centri accademici. Ha poi elencato una dozzina di preoccupazioni di cui aveva assistito, tra cui: partecipanti collocati in un corridoio dopo l'iniezione e non monitorati dal personale clinico, mancanza di follow-up tempestivo dei pazienti che hanno manifestato eventi avversi, deviazioni del protocollo non vengono segnalate, vaccini non vengono conservati a temperature adeguate, campioni di laboratorio etichettati erroneamente e targeting del personale Ventavia per la segnalazione di questi tipi di problemi. Nel giro di poche ore Jackson ha ricevuto un'e-mail dalla FDA ringraziandola per le sue preoccupazioni e informandola che la FDA non poteva commentare alcuna indagine che potesse risultare. Pochi giorni dopo Jackson ha ricevuto una chiamata da un ispettore della FDA per discutere il suo rapporto, ma gli è stato detto che non potevano essere fornite ulteriori informazioni. Non ha sentito più nulla in relazione al suo rapporto".
VIDEO NEWS

SCIENZE
MEDICINA

INTERVISTE

INTERVISTE

INTERVISTE

POLITICA
MEDICINA
MEDICINA
-
 08/07/2023
08/07/2023 -
 18/05/2023
18/05/2023 -
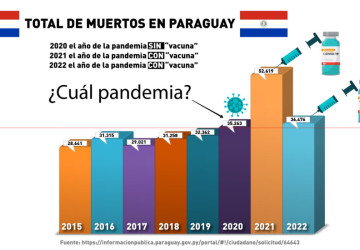 20/03/2023
20/03/2023 -
 11/03/2023
11/03/2023 -
 08/03/2023
08/03/2023 -
 23/02/2023
23/02/2023 -
 16/02/2023
16/02/2023 -
 15/02/2023
15/02/2023 -
 14/02/2023
14/02/2023 -
 04/02/2023
04/02/2023 -
 29/01/2023
29/01/2023 -
 26/01/2023
26/01/2023 -
 26/01/2023
26/01/2023 -
 21/01/2023
21/01/2023
-
 20/05/2021
20/05/2021 -
 21/09/2021
21/09/2021 -
 15/03/2021
15/03/2021 -
 21/07/2021
21/07/2021 -
 06/09/2021
06/09/2021 -
 30/10/2021
30/10/2021 -
 03/08/2021
03/08/2021 -
 27/10/2021
27/10/2021 -
 02/05/2021
02/05/2021 -
 05/05/2021
05/05/2021 -
 08/03/2021
08/03/2021 -
 02/08/2021
02/08/2021 -
 05/10/2021
05/10/2021 -
 10/06/2021
10/06/2021

 Traduttore
Traduttore

LEAVE A COMMENT
Facebook Conversations